|
私たちの研究室では主に 腸管免疫における上皮細胞の役割 と 小胞輸送による細胞内輸送のメカニズム に興味を持ち研究を進めています。この2つの研究テーマは一見全く相異なるプロジェクトのように見えますが、実際には無関係ではありません。腸管上皮細胞の中には M 細胞 とよばれる特殊に発達した細胞が少数存在します。 M 細胞は摂取した食餌性高分子や細菌・ウイルスなどの微生物を積極的に取り込み、基底膜側から排出して粘膜下の免疫担当細胞に供給することで、免疫応答に寄与しています。このように高分子や微生物が細胞質を通り抜けて運ばれる現象はトランスサイトーシスと呼ばれる細胞内輸送の一種です。また、腸管をはじめとする粘膜からは免疫グロブリンである IgA が多量に分泌され、病原微生物や腸内常在菌(腸内フローラ)の数の制御や体内への侵入防止に働いていますが、 M 細胞には IgA に対する受容体 があり、 IgA と結合した抗原のトランスサイトーシスを促進しています。そこで私たちは、上皮細胞をキーワードに細胞生物学と免疫学の研究に取り組んでいます。
腸管免疫とは・・・
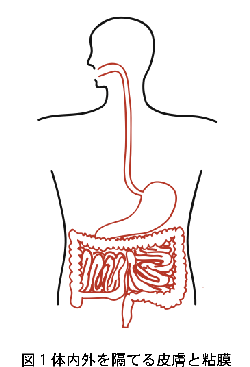
体の内と外の境界は粘膜(図1の赤線部分)および皮膚(図1の黒線部分)によって形成されます。何層もの表皮細胞や角質によって体表面に堅牢な防壁を形成する皮膚と異なり、粘膜は通常一層の上皮細胞からなるため微生物の侵入に対して比較的弱く、実際ほとんどの病原微生物の侵入経路となっています。従って粘膜は、免疫系がこれら病原体の感染から身体を守る最も重要な部位のひとつと考えられます。粘膜系の中でも特に腸管粘膜は、約400m 2 (テニスコート1面半)にも及ぶ表面積を持ち、抗体を作る B 細胞やそれを助ける T 細胞、腸に存在する特別な免疫器官であるパイエル板(図2)のリンパ球など、全身の末梢リンパ球の実に60?70%もが集結する体内最大の免疫組織です。腸管粘膜は食物の摂取を通して常に膨大な量の蛋白質や病原微生物に曝されており、さらに腸内には多数の非病原性細菌群(腸内フローラ)が共生しています。腸管の免疫系は、生体がこれらの異物と接するまさにその場所でそれらを監視し応対するという重要な役割を果たしています。われわれのからだ(免疫系)は、食物の成分や常在細菌叢には反応せず、病原体には反応してこれを排除するように出来ており、それを調節しているのが粘膜免疫系です。例えば、本来反応しないはずの卵の成分に対する過剰な免疫反応が惹起されると、結果として卵に対する食物アレルギーという病気が発症してしまいます。粘膜免疫系はこのようなことが起こらないよう厳密に制御されていますが、その仕組みはまだよくわかっていません。このような粘膜免疫系の研究によって得られる知識は、効果的なワクチンや新たな薬物の投与法の開発、さらには自己免疫疾患やアレルギーの治療への応用が期待されます。
M 細胞の発生分化および機能の分子メカニズムの解明
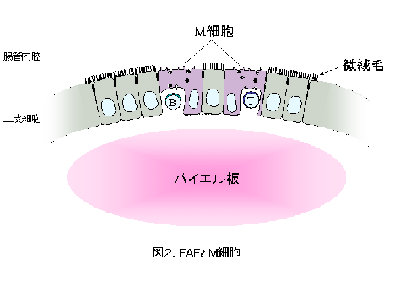
パイエル板や孤立リンパ小節などの腸管関連リンパ組織( gut-associated lymphoid tissue; GALT )を覆う粘膜( follicle-associated epithelia; FAE )は 通常の絨毛上皮とはやや性質が異なります。中でも、 特殊に分化した上皮細胞である M 細胞 と呼ばれる微絨毛の発達していない細胞は、基底膜に接する細胞膜が大きく陥凹して M 細胞ポケットと呼ばれる空洞上の構造を形成し 、そこに T細胞やB細胞を抱え込んでいます。 腸管粘膜は経口摂取された食餌性の高分子抗原や病原微生物、腸内フローラを形成する常在細菌叢に常に曝されており、 M 細胞はこれらの腸管内腔に存在する異物抗原をトランスサイトーシスにより GALT の免疫担当細胞に供給するサンプリングの主要経路として、免疫監視・免疫応答に重要な役割を担っています。したがって、その機能の人為的操作は免疫応答そのものの制御に繋がります。しかし M 細胞は数が少なく、特異的な表面マーカーもないことから、その発生・分化や機能の分子機構はほとんど明らかではありません。 私たちは M 細胞の発生分化や機能の解明を通して免疫応答の調節機構を明らかにしたいと考え、以下の研究を進めています。
1.M細胞の分化・機能に重要な分子の探索
独自に開発した粘膜上皮層剥離法を用いてマウス腸管から M 細胞に富む FAE 、およびコントロールとして M 細胞を含まない絨毛上皮を単離し、 RNA を抽出・増幅し、これらを材料にマイクロアレイによる遺伝子発現パターンの比較を行い、 M 細胞特異的に発現する遺伝子候補群を同定しています。現在リアルタイム定量 PCR 、 in situ hybridization を用いて、これらの中から M 細胞特異的な機能を持つ、あるいは M 細胞の表面マーカーとなる可能性のある遺伝子の絞り込みを行っています。
2. IgA 受容体の同定
M細胞には未知の IgA 受容体の発現が報告されています( J. Immunol. 169:1844-1851, 2002; J. Immunol. 172: 3026-3033, 2004 )。そこで私たちはこの IgA 受容体のクローニングを試みています。
既知の IgA 受容体であるポリ Ig 受容体や Fc a/m 受容体の Ig ドメインとのホモロジー検索から、新たな IgA/IgM 受容体を見出しました。免疫組織染色の結果、この分子は当初の目的であるM細胞ではなく、心臓や腎糸球体などをはじめとする種々の臓器の毛細血管内皮細胞特異的に発現することが明らかとなりました。現在その機能を解析中です。また、 M 細胞特異的に発現する IgA 受容体のクローニングも引き続き試みています。
細胞内蛋白輸送機構
真核生物の細胞内は脂質膜(脂質2重層)で囲まれた種々のオルガネラで満たされています。それぞれのオルガネラはその膜上あるいは内腔に固有の蛋白質のセットを持っており、このように異なる蛋白質群を持つことでそれぞれのオルガネラ特有のユニークな機能が発揮されます。蛋白質のほとんどは細胞質において mRNA から翻訳されてできるため、細胞はこれらの新たに合成された蛋白質をそれぞれが局在するべき個々のオルガネラへと選択的に輸送する機構を備えています。このような蛋白質のオルガネラへの選別輸送機構が正確に働いてはじめて各オルガネラ特有の機能が保たれ、細胞が生存できるのです。細胞内蛋白質輸送機構は、その輸送方式から大きく3つに分類できます。
「ゲートのある輸送( gated transport )」は、核膜孔によってつながった空間的に等価な区画である細胞質と核質とを結ぶ蛋白質輸送機構です。核膜は外膜と内膜の2枚の脂質2重層からできていますが、核膜孔はこの2重膜を貫いて存在する核膜孔複合体という高分子蛋白質複合体です。核膜孔複合体はチャネルのような構造であり、約30kD以下の比較的小さな分子は拡散により自由に通しますが、ある程度以上の大きさの巨大蛋白質や分子複合体に関しては選択性を持って能動的に輸送する関門(ゲート)として機能します。
「膜を透過する輸送( transmembrane transport )」では、オルガネラの膜上に存在する膜透過装置が輸送される蛋白質を特異的に認識して、空間的に等価でない細胞質からオルガネラ内腔へと選択的に通過させます。膜透過装置は一般にシグナル配列を認識する部位や細い通路(チャネル)の様な構造を持ち、運ばれる蛋白質は高次構造がほどけた状態で膜透過装置のチャネルを糸のようにすり抜けます。このような機構は小胞体、ミトコンドリア、色素体(葉緑体)、ペルオキシソームといったオルガネラへの蛋白質輸送でみられます。
小胞輸送とは・・・
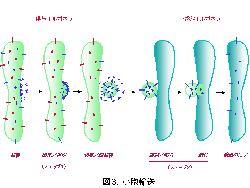
第3の輸送方式は「小胞輸送( vesicular transport )」と呼ばれます。(文科省科研費 特定領域研究「トラフィック」の HP も参照。)小胞体、ゴルジ体、エンドソーム、リソソームなどのオルガネラは、細胞膜が細胞内に陥凹して生じた「細胞内膜系」のオルガネラであり、従ってその内腔は細胞外と空間的に等価です。新たに合成された蛋白質は小胞体へと挿入され、ゴルジ体を経てトランスゴルジ網( trans-Golgi network )へと輸送される間に正しい高次構造への折りたたみや糖鎖の修飾などを受けます。トランスゴルジ網に達した蛋白質は、細胞膜、エンドソーム、リソソーム、さらには内・外分泌細胞においては調節性分泌顆粒などへと選別輸送されます。また、エンドサイトーシスによって取り込まれた蛋白質は通常エンドソームへと輸送され、そこからさらに細胞膜へとリサイクリングされるもの、リソソームへと運ばれるもの、トランスゴルジ網へと輸送されるものなどに選別されます。小胞輸送は、これらの区画間を結ぶ蛋白質輸送系の総称です。輸送担体は通常、輸送小胞( transport vesicle )と呼ばれるオルガネラの膜から出芽してできる小さな球状構造のことが多いのですが(図3)、より大きな不定形の、オルガネラの破片のような場合もあります。図3に示すように、 供与側のオルガネラ膜から輸送小胞が出芽する際そこに留まるべき分子(赤で表す可溶性及び膜蛋白質)から受容側に輸送されるべき‘積み荷'蛋白質(青で表す可溶性及び膜蛋白質)を選別して特異的に小胞に積み込む機構(ステップ1)、運搬された小胞が受容オルガネラ膜とのみ結合・融合して輸送が正しく行われるための機構(ステップ2)が存在し、大量の物質交換を行いながらも各オルガネラの特異性を保持しなければならないという矛盾を解決しています。輸送小胞は被覆蛋白質と呼ばれる蛋白質群が細胞質からオルガネラ膜上に付着して膜を変形させることにより形成が始まります。被覆蛋白質は、積み荷蛋白質に存在する輸送シグナルを特異的に認識する「選別( sorting )」にも関与します。被覆蛋白質の違いから これまでに、 COP I 小胞、 COP II 小胞、クラスリン小胞 の3つが代表的な輸送小胞として知られています。 COP I 小胞はゴルジ体から小胞体への輸送およびゴルジ体層板間の輸送、 COP II 小胞は小胞体からゴルジ体への輸送、クラスリン小胞はトランスゴルジ網?エンドソーム・リソソーム間およびエンドサイトーシス、というように輸送経路ごとにそれぞれ異なる小胞が使われることによって輸送の特異性が保たれているのです。クラスリン小胞はその被覆蛋白質である AP 複合体の違いによりさらに複数のサブタイプが存在し、輸送の多様性を生み出しています。 AP 複合体には神経細胞あるいは上皮細胞特異的に発現するアイソフォームも存在し、それぞれエンドソームからの de novo のシナプス小胞の形成、側底面細胞膜への極性輸送に関与しています。
AP 複合体による小胞の形成と積み荷蛋白質の選別
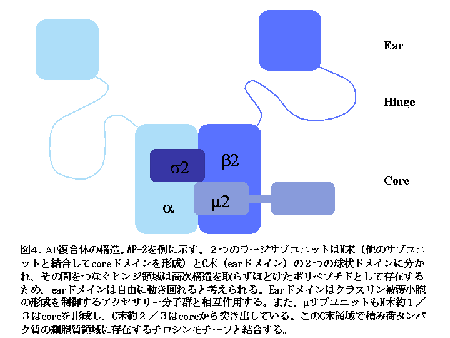
AP 複合体はクラスリン被覆小胞のストイキオメトリックな被覆成分として、クラスリンのオルガネラ膜への結合に際してアダプターとして働くとともに(これが名前の由来である)、積み荷蛋白質の輸送シグナルの認識も行います。 AP 複合体はファミリーを形成しており(表1)、それぞれのファミリーメンバーが異なるオルガネラ膜と結合し、異なる積み荷蛋白質を認識することで、「ポストゴルジ・ネットワーク」における輸送の特異性を生み出す重要な分子です。 AP 複合体は図4に示すように異なる4つのサブユニットからなるヘテロ4量体です。サブユニット間の結合は強固であり、細胞内ではサブユニット単独で存在することはなく常に4量体として存在しています。
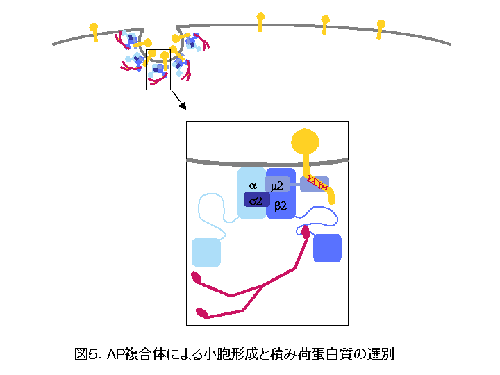
AP-2 を例に、 AP 複合体による小胞の形成と積み荷蛋白質の選別について説明します(図5)。 AP-2 は a サブユニットと細胞膜との親和性により細胞質から細胞膜へとリクルートされ、さらに b サブユニットとの親和性によりクラスリンが細胞質から細胞膜へと結合して小胞の形成が始まります。積み荷蛋白質は拡散により細胞膜上を比較的自由に移動していると考えられますが、形成されつつあるクラスリン小胞にさしかかると、その細胞質領域に存在する輸送シグナルと AP 複合体をはじめとする小胞の被覆蛋白質群との結合特異性により選択的に小胞に取り込まれます。代表的な輸送シグナルのひとつであるチロシンモチーフは、 YXX O 配列( Y はチロシン、 X は任意のアミノ酸、 O はロイシン、イソロイシン、メチオニン、フェニルアラニン、バリンなどの大きな疎水性側鎖を持つアミノ酸)という共通配列を持ち、これが m サブユニットの C 末ドメインと特異的に結合することにより、クラスリン小胞に取り込まれます。こうして小胞が完成すると、図3のようにクラスリンや AP-2 などの被覆蛋白質群は小胞膜から解離して細胞質へと戻り、次の小胞形成へとリサイクルされ、一方被覆を失った小胞は受容オルガネラであるエンドソーム膜と融合して積み荷蛋白質をエンドソームへと運び入れます。

私たちの研究室では上皮細胞特異的に発現する AP-1B および神経細胞特異的に発現する AP-3B に関して研究しています。
●上皮細胞特異的に発現する AP-1B 複合体の研究
私たちは新たな m サブユニット遺伝子 m 1B をクローニングし、 m 1B を含む AP-1B 複合体が上皮細胞特異的に発現しており( FEBS Lett. 1999 )、上皮細胞における側基底面細胞膜への極性輸送を担っていることを明らかにしてきました( Cell 1999; MBC 2002 )。現在 m 1B 遺伝子欠損マウスを樹立・解析中です。
● 神経細胞特異的に発現する AP-3B 複合体の研究
AP-3B 複合体は神経細胞特異的に発現しています。私たちは AP-3B の神経特異的サブユニットである m 3B 遺伝子欠損マウスを樹立・解析しています。その結果、 AP-3B がシナプス小胞のエンドソームからの de novo の形成に関与すること( J. Neurosci. 2001 )、 AP-3B 遺伝子欠損マウスはてんかんけいれんを起こすことがわかりました。AP-3B 欠損マウスではシナプス小胞の形態や数に異常が認められ、また抑制性の神経伝達物質である GABA の放出が若干低下していることから、抑制性神経伝達の障害の結果相対的に神経興奮性が増加することがてんかんけいれんの原因と考えられます( J. Cell Biol. 2004 )。この成果はてんかん研究の新たな局面を拓いた注目すべき論文として J. Cell Biol. の「 In This Issue 」や Nature Review Neuroscience の「 Research Highlights 」で紹介されると共に、読売新聞など数紙にも取り上げられました。
|





